Potencial quimico
El concepto de potencial químico es el fundamento para establecer los criterios de equilibrio entre las fases de las sustancias. Es el parámetro que está relacionado con la energía libre de Gibbs y constituye la fuerza impulsora de las transformaciones físicas.
A partir de este concepto, se analizarán y aplicarán los criterios de equilibrio entre fases.
En un diagrama termodinámico podemos establecer las condiciones de equilibrio entre las fases cuando existe una igualdad en los valores del potencial químico:
Este criterio de equilibrio se aplica a cuales quiera de los diferentes equilibrios que se pudieran presentar, aunque también es conocido que para una sustancia pura el máximo número de fases en equilibrio es de tres.
Las ec. de Gibbs no son aplicables en el caso de sistemas abiertos en los que se intercambia materia con el medio ambiente, ni en procesos irreversibles como por ej una reacción química (en la que cambia la composición), y en los que evidentemente los químicos tenemos gran interés. Si la composición varía, el número de moles de cada especie ni será otra variable a considerar.
Así, para determinar como varían la funciones termodinámicas durante un proceso irreversible como pueda ser una reacción química, lo que se hace es "congelar" la reacción y variar la composición del sistema de forma reversible modificando en una cantidad dni la composición del sistema, y observando como varía U, H, A, G (la variación será la misma que cuando la modificación es irreversible puesto que son funciones de estado)
Por ejemplo:
y por tanto:
Por definición, se llama potencial químico, µ, a:

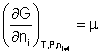
No hay comentarios:
Publicar un comentario