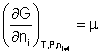Potencial de membrana
Las células animales mantienen una diferencia de potencial a través de la membrana plasmática que ronda los 90 mV, siendo el interior electronegativo con respecto al exterior.
En principio podríamos distinguir varios motivos por los que existe una separación de cargas a través de diversos tipos de membranas biológicas. Por un lado, muchos de los componentes estructurales de la membrana son ionizables a pH celular y podría pensarse que una distribución asimétrica de estos grupos con diferentes pK daría lugar a una diferencia de potencial similar a la observada. Por otro lado, algunas proteínas transportadoras acopladas a la hidrólisis de ATP, notablemente la bomba de sodio y potasio, son electrogénicas. Esto significa que en la operación normal del transportador se separan cargas, o dicho de otra forma, son generadores de corriente. Por último, en situaciones en las que existen gradientes de potencial electroquímico de iones a través de la membrana pueden aparecer potenciales de difusión.
Con respecto a los componentes cargados de las membranas biológicas, debe tenerse en cuenta que la presencia de un electrolito en un medio en el que las cargas pueden moverse libremente provocaría la neutralización parcial de la carga del mismo, por parte de los contraiones en solución. Sin embargo no es imposible que de existir diferencias de densidad superficial de carga entre ambas láminas de las bicapas, éstas contribuyan a la generación o estabilización del potencial de membrana. Se ha propuesto que estas cargas, si bien no contribuyen al potencial transmembrana global, pueden tener un efecto local sobre las proteínas de transporte. La consideración de estos aspectos excede los objetivos de este texto.
Sin embargo, son otros los factores que se consideran fundamentales en la generación del potencial de membrana. Entre los transportadores electrogénicos, es obvia la contribución de la bomba de sodio y potasio al potencial de membrana. El carácter electrogénico se pone en evidencia al constatar que la estequiometría fenomenológica de la bomba es de aproximadamente 3 iones Na+transportados hacia el exterior celular y 2 iones K+hacia el interior celular, por cada molécula de ATP hidrolizada, o sea, en cada ciclo de la bomba se transporta una carga positiva hacia el exterior de la célula. En las células excitables, el flujo de la bomba en condiciones de reposo transporta una corriente de 1,8 μA/cm2.
En condiciones de reposo, la contribución electrogénica de la bomba de sodio al valor del potencial de membrana en células excitables, y en la mayoría de las células animales, es del orden del 10 % del potencial.
El papel más importante de la bomba es indirecto, es decir, es la “encargada” de mantener el gradiente electroquímico de los iones sodio y potasio a través de la membrana plasmática celular. Estos gradientes son fundamentales en el establecimiento del potencial de difusión. La mayor parte de las células deben su potencial de membrana a este mecanismo
En la imagen citada con anterioridad se puede observar como es que actua la bomba sodio potacio que por lo general es estudiada principalmete en la neuronas, donde se debe de llevar los impulsos nerviosos por medio de este metodo.
Bibliografía
http://biofisica.fcien.edu.uy/potencial_de_membrana.pdf